Nano Res.[生物]│袁弘教授课题组:靶向发炎结肠的ROS响应性纳米粒通过修复屏障和抗炎协同治疗炎症性肠病
本篇文章版权为袁弘教授课题组所有,未经授权禁止转载。

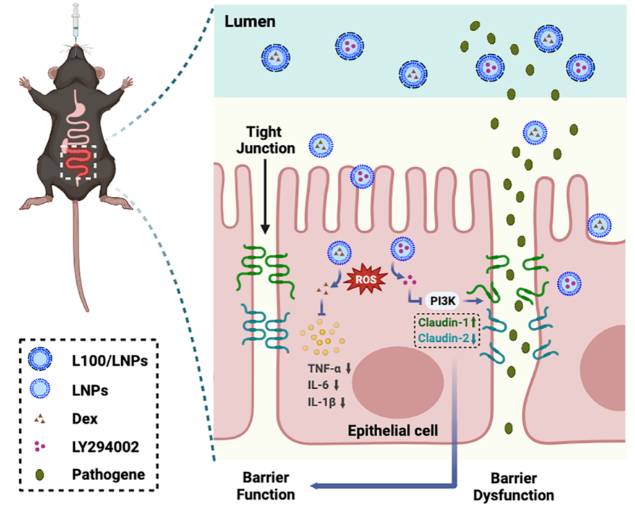
炎症性肠病(IBD)是一种慢性复发性炎症性疾病包括克罗恩病(CD)和溃疡性结肠炎(UC)。IBD的病因复杂不明,与多种致病因素有关,主要包括遗传因素、肠道菌群失调、免疫系统失调、肠道屏障损伤等,因此目前仍无法彻底治愈。以往IBD的治疗大多侧重于抑制过度的免疫反应以减少炎症。最近的研究表明,肠道屏障损伤先于IBD的发生,肠道屏障功能障碍使得肠腔内容物进入体内,触发先天和适应性免疫细胞的激活,在疾病发生发展过程中,肠道屏障功能持续被破坏,粘膜免疫系统失调,导致进行性组织损伤,最终导致临床IBD。
浙江大学袁弘教授课题组提出主动干预屏障修复过程并结合抗炎的新策略,具有提高抗炎疗效,防止复发,避免IBD进一步恶化的优势。该研究报道了一种靶向发炎结肠的ROS响应性纳米粒,通过口服方式同时递送抗炎药醋酸地塞米松(Dex)和屏障功能调节剂LY294002(LY),LY通过调节肠紧密连接蛋白恢复肠道屏障完整性,同时配合抗炎治疗,实现了对IBD的靶向协同治疗。
通过溶剂扩散法获得⍺-T-TK-MG LNPs和Eudragit L100包衣⍺-T-TK-MG LNPs (L100/⍺-T-TK-MG LNPs)。纳米粒分散液呈蓝色乳白色,粒径分布均一,透射电镜下显示形态完整,呈球形。Dex和LY均为疏水性药物,可良好包裹在脂质材料中。同样采用溶剂扩散法制备四种载药纳米粒,处方筛选得到最佳投药量为10%,最佳包衣比为50。粒径电位结果如图1所示,包衣后的纳米粒的粒径增加,Zeta电位发生翻转,负电荷能更好的靶向带正电的发炎结肠。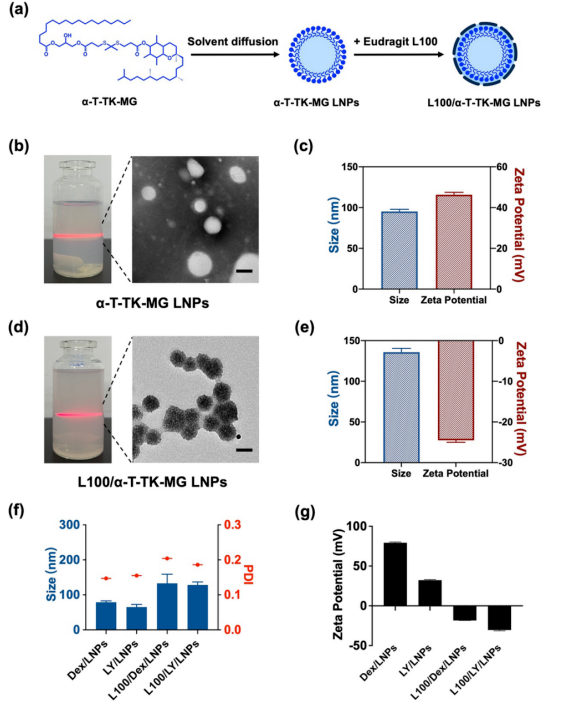
图1脂质纳米粒的合成与表征。(a)⍺-T-TK-MG LNPs和L100/⍺-T-TK-MG LNPs的制备路线。(b)⍺-T-TK-MG LNPs的透射电镜图像。(c)⍺-T-TK-MG LNPs的尺寸和Zeta电位。(d) L100/⍺-T-TK-MG LNPs的透射电镜图像。(e) L100/⍺-T-TK-MG LNPs的尺寸和Zeta电位。(f) Dex/LNPs、LY/LNPs、L100/Dex/LNPs和L100/LY/LNPs的尺寸。(g) Dex/LNPs、LY/LNPs、L100/Dex/LNPs和L100/LY/LNPs的Zeta电位。将⍺-T-TK-MG/LNPs用不同浓度的H2O2(0、1、10×10-3 M)中处理,如图2(a)和图2(b)所示。在正常环境(0 M H2O2)下纳米粒粒径变化不明显,在模拟炎症环境(1和10 × 10-3 M H2O2)下纳米粒粒径增大。特别是在10 × 10-3 M H2O2条件下,粒径迅速增大到2000 nm以上,说明纳米粒中的TK键在H2O2的作用下分解,结构被破坏,导致纳米粒聚集,粒径增大。在体外释放中也可以观察到ROS响应性,随着H2O2浓度增加,药物释放速度增加。同时可以观察到,L100包衣的纳米粒对胃酸具有抵抗力,使药物可以缓慢释放,减少泄漏。这些结果表明,L100/⍺-T-TK-MG/LNPs由于TK键而具有ROS响应性,并且由于Eudragit L100对pH敏感而在胃液中具有保护和缓释作用。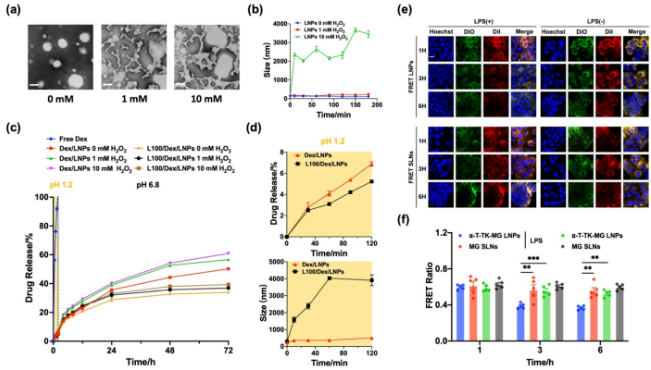
图2模拟胃肠道环境下和细胞内的载体响应性释放行为。(a)⍺-T-TK-MG LNPs在不同浓度H2O2 (0 mM、1 mM、10 mM)作用下透射电镜下形态变化。(b)⍺-T-TK-MG LNPs在不同浓度H2O2下的粒径变化。(c)载药LNPs在含不同浓度H2O2的模拟胃液(pH = 1.2)和模拟肠液(pH = 6.8)中的体外释放曲线。(d) Dex/LNPs和L100/Dex/LNPs在模拟胃液中的药物释放和大小变化。(e)正常Caco-2细胞和炎症刺激Caco-2细胞摄取3 h后1、3和6 h的CLSM图像。(f)图(e)荧光FRET比率半定量结果。如图3(a)和图4(b)所示LPS处理炎症刺激的Caco-2细胞单层的TEER在0 h时逐渐下降到初始值的80%左右,表明Caco-2细胞的屏障被破坏。Dex/LNPs和LY/LNPs联合处理能够恢复细胞单层的跨膜抗性,且能降低细胞单层的渗透性,表明Dex/LNPs和LY/LNPs联合处理对炎症刺激的细胞单层具有保护作用,并能维持细胞屏障的稳定性和完整性。图4(c) ~ (e)显示,Dex/LNPs和LY/LNPs联合处理的炎症刺激的Caco-2细胞中TNF-α、IL-6和IL-1β等炎症因子含量最低,说明Dex/LNPs和LY/LNPs协同治疗在体外具有较强的抗炎作用。基于以上结果,我们研究了Dex/LNPs和LY/LNPs联合处理对炎症刺激的Caco-2细胞的作用机制。结果表明,Dex/LNPs和LY/LNPs联合治疗利用LY抑制PI3K/Akt信号通路的作用,进而调节在肠屏障中起重要作用的TJ蛋白Claudin-1和Claudin-2,最终起到保护肠道屏障和抗炎协同治疗的效果。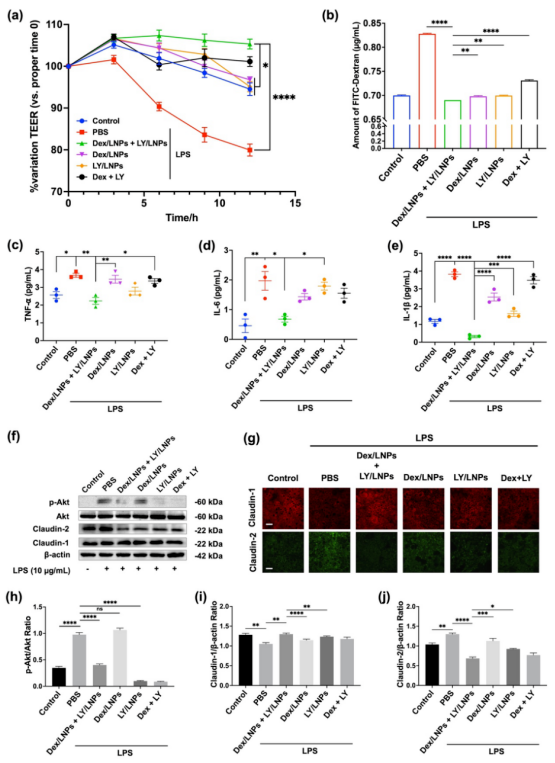
图3 Dex/LNPs和LY/LNPs联合处理对炎症刺激的Caco-2细胞的协同作用及其机制。(a) Caco-2单层细胞跨膜电阻的变化。(b) Caco-2细胞单层的跨膜通透性。(c-e)不同处理后炎症刺激的Caco-2细胞中TNF-α、IL-6和IL-1β含量。(f)不同处理的Caco-2细胞p-Akt、Akt、Claudin-1和Claudin-2蛋白印迹条带。(g)Claudin-1和Claudin-2免疫荧光染色。(h-j) p-Akt、Claudin-1和Claudin-2含量半定量分析。体内药效学试验结果显示,L100/Dex/LNPs和L100/LY/LNPs联合组能够更好地减轻体重减轻和降低疾病活动指数(DAI)值,通过抑制上皮破坏、隐窝结构异常、杯状细胞耗竭和免疫细胞浸润,来减轻结肠组织损伤,同时降低了炎症因子TNF-α、IL-6和IL-1β的含量,表明炎症被抑制。IBD复发的生物标志物粪便钙卫蛋白水平显著降低,表明联合组可能有效预防复发。综上所述,这些结果表明L100/Dex/LNPs和L100/LY/LNPs联合治疗具有显著的协同作用,通过结肠靶向ROS响应性纳米载体主动修复屏障和抗炎。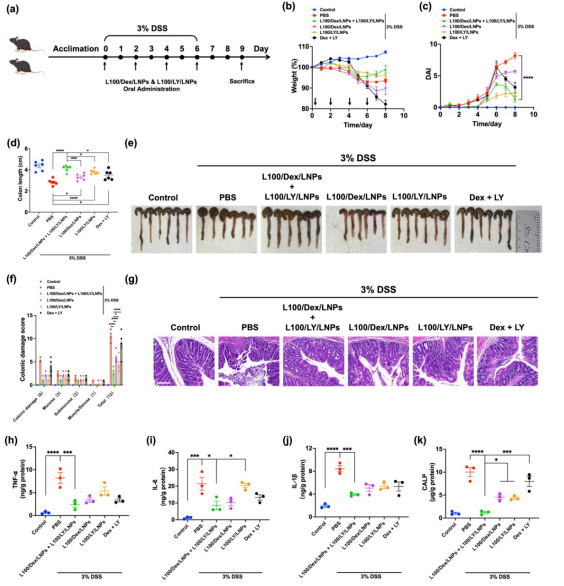
图4 L100/Dex/LNPs和L100/LY/LNPs联合治疗对结肠炎小鼠的疗效。(a)给药时间表。(b, c)8天的每日体重和DAI变化。(d, e)第9天处死后切除的结肠(e)和结肠长度(d)。(f, g)结肠H&E染色切片(g)和结肠组织损伤评分(f)。(h-j)结肠组织中炎症因子TNF-α、IL-6和IL-1β含量。(k)小鼠粪便钙卫蛋白含量。
王丁:浙江大学药学院博士生,师从袁弘教授,于2020年获得浙江大学理学学士学位。目前的研究方向是基于脂质纳米粒的药物递送系统,重点关注其在炎症性肠病治疗中的应用。
袁弘教授:主要从事脂质纳米给药系统、靶向共聚物胶束给药系统等新型药物制剂的研究与新制剂的开发。在难溶性药物、多肽蛋白类药物的口服给药研究,口服淋巴靶向基础理论研究,智能递送给药系统的纳米材料与纳米载体分子设计等领域,取得了一些重要进展。主持和参加国家自然科学基金项目、国家重大科学研究计划(973)项目、浙江省科学技术厅重大科技攻关项目等多项研究。




































 京公网安备 11010802027423号
京公网安备 11010802027423号