分子骨架编辑新突破——带官能团的碳原子插入茚环
副标题:光氧化还原催化的官能团化碳原子插入实现茚的扩环反应
基于原子插入、删除和替换等分子骨架编辑方法,化学家可以通过对分子(尤其是结构复杂的药物分子)进行针对性的重塑,这使得分子骨架编辑已成为当代有机化学中的重要策略(图1a)。其中特别值得关注的是通过碳原子插入实现扩环的过程。与其它单原子插入反应相比,碳原子的优势在于其含有四个共价键,进而可以引入官能团并为分子多样化提供更多策略。然而,由于去芳构化和C-C键裂解过程需要较高的能垒,因此要想实现芳环体系的单原子插入反应仍极具挑战性。尽管Ciamician-Dennstedt重排反应是目前已知最早实现碳原子插入芳环骨架的例子,即由氯仿生成的二氯卡宾在吲哚环体系中进行环加成并得到二氯环丙烷中间体,再在强碱的作用下进一步重排得到所需的扩环产物(图1b),但是竞争性的Reimer-Tiemann反应、苛刻的反应条件、低收率且只能获得卤化产物等限制了其应用。最近,化学家们利用卡拜阳离子等效试剂(如:α-卤代重氮烷烃和α-氯二嗪)成功地将吲哚转化为喹啉体系(图1c),但是很少有人关注茚扩环构建萘的反应,仅仅是Reiff等人在1955年报道过。尽管经典的卡拜等效物α-碘鎓重氮化合物可作为卡拜自由基前体并且此类试剂可引入各种官能团,但是卡拜自由基等效物在活化后会产生三种可能的中间体,即碳自由基[∙C(N2)-R]、卡宾[X-C(:)-R]和游离卡拜物种[:Ċ-R](图1d),因此必须调节N2释放和自由基生成的相对速率来选择性形成单一的反应中间体。
近日,德国明斯特大学的Frank Glorius教授(点击查看介绍)与美国德克萨斯农工大学的Osvaldo Gutierrez 教授(点击查看介绍)课题组合作,利用α-碘鎓重氮化合物作为自由基卡拜前体,通过光氧化还原策略成功地实现了官能化碳原子对茚的插入反应(图1e),并以良好的产率构建了一系列2-位官能团化萘。该反应支持带有多种官能团的碳原子插入,包括三氟甲基、酯、磷酸酯、磺酸酯、砜、腈、酰胺、芳基酮和脂肪酮等。此外,密度泛函理论(DFT)计算表明该反应可能涉及自由基链过程,并通过重氮自由基与茚的加成进行的。相关成果发表于Nature Catalysis 上。
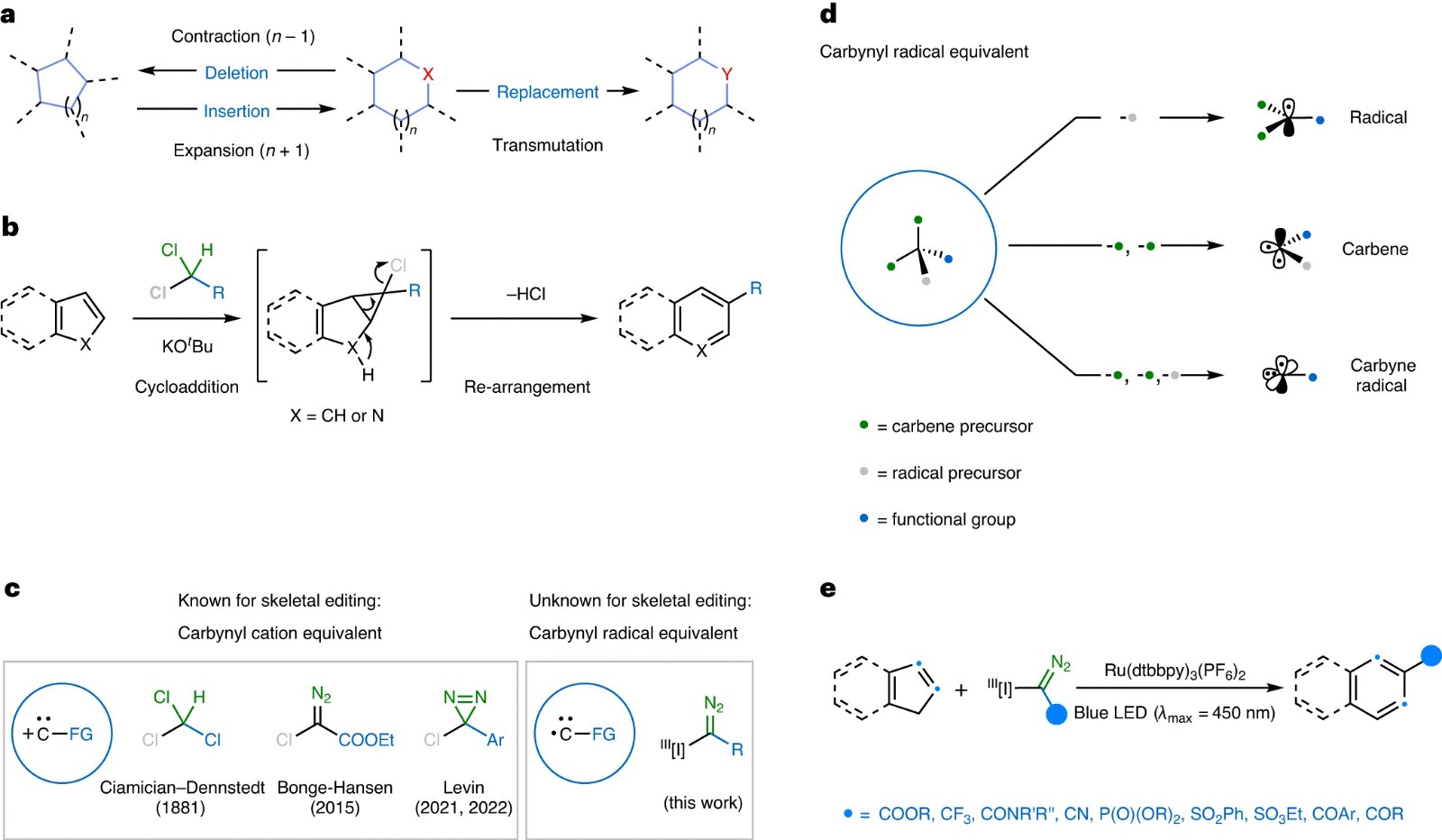
图1. 背景介绍。图片来源:Nat. Catal.
首先,作者选择未取代茚(1a)为模板底物、Ru(dtbbpy)3(PF6)2为光催化剂、Na2CO3为碱、CH3CN为溶剂在蓝光照射下对carbynyl阳离子等价物进行了筛选(图2a),结果显示α-氯、α-溴和α-碘代重氮乙酸乙酯(2a-2c)无法获得所需产物,这可能是由于环丙烷中间体无法消除所致;而使用化合物(2d)和(2e)作为等价物时,分别以80%和74%的产率获得所需产物3a。此外,另一种高价碘重氮化合物(2f)和(2i)分别以75%和26%的产率获得产物3a,并且高价碘重氮化合物芳环上的吸电子基团略微降低了产率(2g和2h),而供电子基团(如:OMe)却由于高度不稳定性而快速分解。如图2b所示,对照实验表明光、光催化剂以及碱对反应至关重要,缺一不可。值得注意的是,该反应仅对高氧浓度敏感,而溶剂含水量、温度、光照强度和浓度对反应的影响很小(图2c)。

图2. 碳原子插入反应条件筛选。图片来源:Nat. Catal.
在最优条件下,作者对扩环反应的茚底物范围进行了考察(图3),结果显示苯环上吸电子基团(如:卤素(3b-c、3e-3f、3h)、三氟甲磺酸酯(3g)、三氟甲基(3k)、硝基(3n)、氰基(3o)、苯基磺酰基(3p))、供电子基团(如:硫甲基(3l))、杂环(如:噻吩(3j)和吡啶(3m))取代的茚均能兼容该反应,以中等至较好的产率获得相应的2-萘酸乙酯。此外,2-取代茚(3q和3r)也能获得相应的扩环产物,但是3-取代茚仅生成少量产物并且有部分原料剩余,作者推测在自由基[∙C(N2)COOEt]加成到茚和SET后,位阻效应不利于所得阳离子对卡宾的加成过程。另一方面,含有卤素(3w、3x)、氰基(3y)、硅基(3z)、酯基(3aa)、磷酸盐(3ab)、硼酸酯(3ad)和烯基(3ae)的脂肪链取代的茚同样能实现这一转化,并以中等至较好的产率获得相应产物。值得注意的是,该方法还能以31%的产率从四取代茚得到三取代萘(3af)。然而,将吲哚置于相同条件下进行反应时仅获得10%的喹啉产物,作者推测这可能是由于吲哚与2d的竞争性直接亲核加成所致。其次,一系列含有不同官能团(如:末端烯烃、末端炔烃、苯酚、磷酸酯、磺酸酯、砜、氰基、酰胺、芳基酮、甲基酮等)的α-碘鎓重氮化合物同样可以参与该反应(图4),并以40-97%的产率得到所需产物(4f-4t)。需要指出的是,该反应还能以良好的产率合成多种三氟甲基萘(4a-4e),而先前的合成方法通常很繁琐。
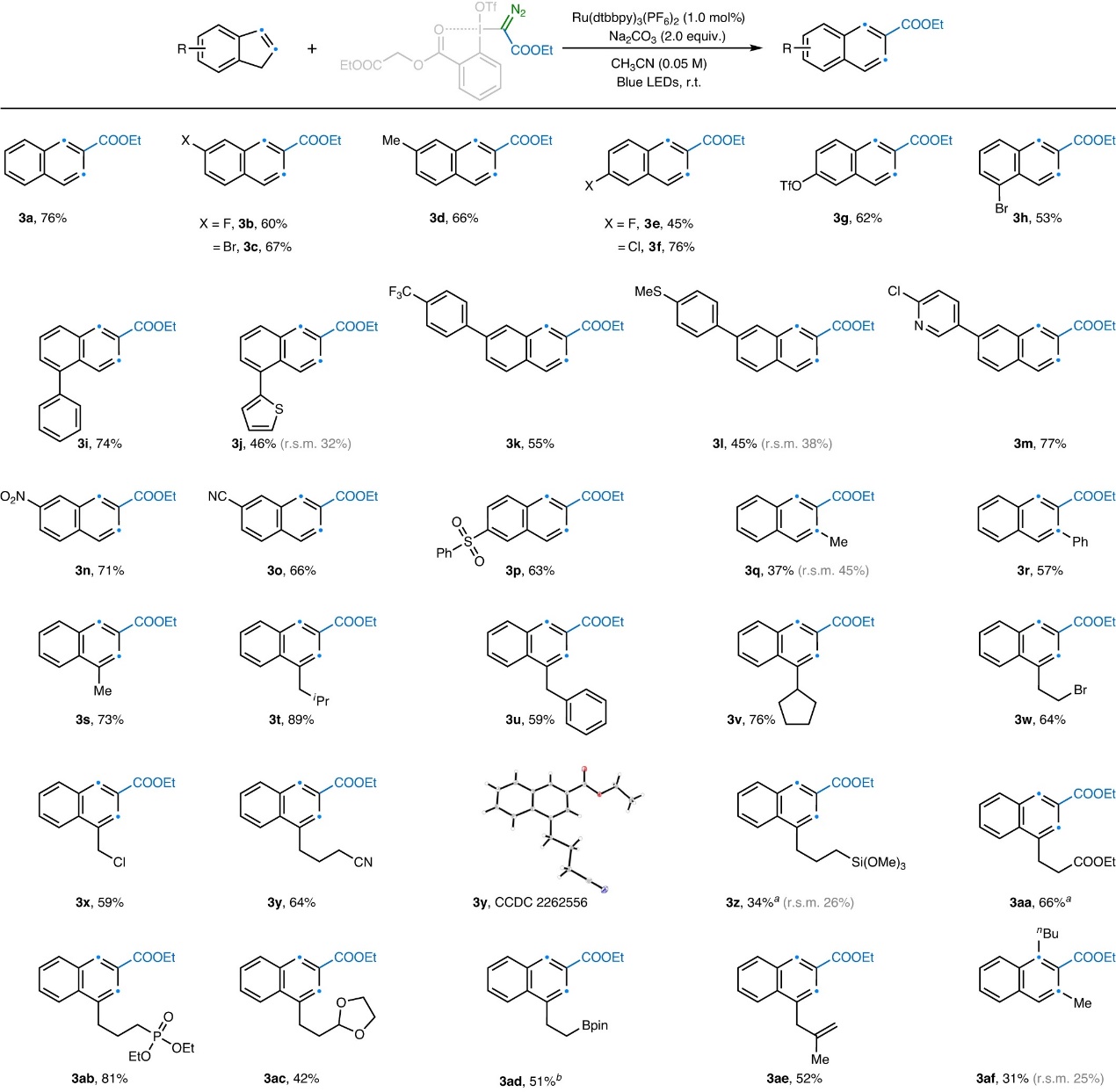
图3. 底物拓展一。图片来源:Nat. Catal.
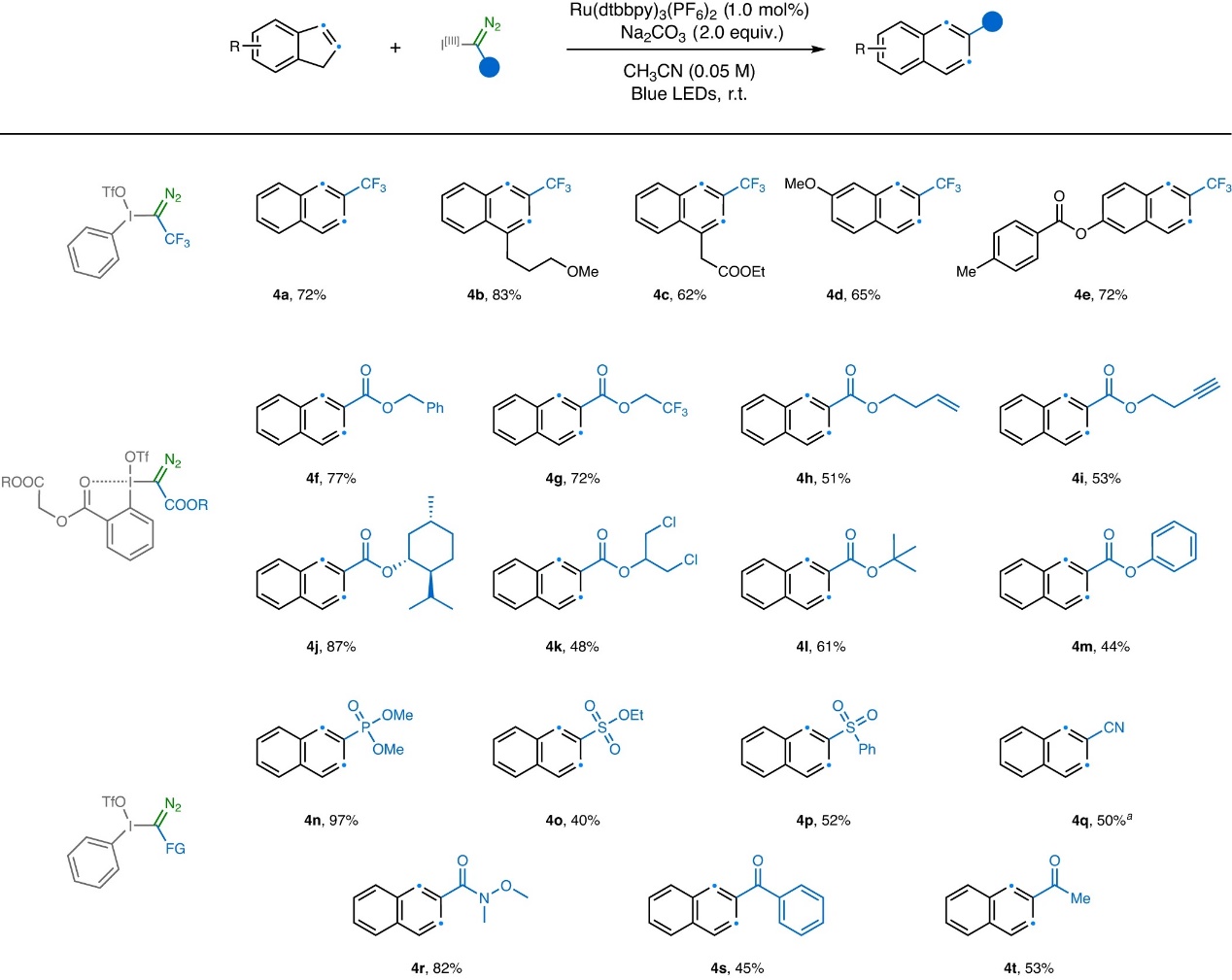
图4. 底物拓展二。图片来源:Nat. Catal.
随后,作者将该策略应用于多环化合物和药物分子的合成,具体而言:1)联茚化合物在标准条件下可以32%的产率得到相应的联萘-3,3'-磷酸酯5a(图5a);2)对醛固酮合酶抑制剂骨架进行了直接修饰并获得相应产物5b(产率:42%,图5b);3)从茚衍生物出发,经茚扩环反应、硼化反应以及Suzuki-Miyaura反应三步转化实现了含萘药物阿达帕林衍生物5d的全合成(图5c)。
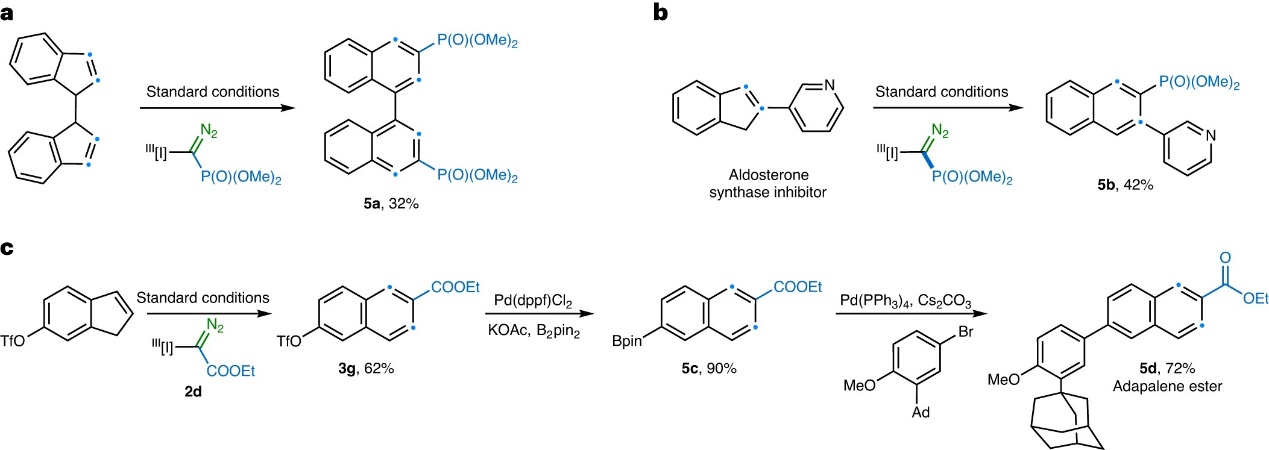
图5. 合成应用。图片来源:Nat. Catal.
为了进一步探究反应机理,作者进行了一系列实验,具体而言:1)紫外-可见吸收光谱表明光催化剂Ru(dtbbpy)3(PF6)2和 2d在激发波长(λmax=450 nm)附近都是吸光物种(图6a)。此外,对照实验表明在没有光催化剂的情况下,用更高能光源(λmax=450 nm、405 nm和365 nm)照射反应混合物并没有观察到所需产物(图6b),同时茚的转化率较低且仅分离出邻碘苯甲酸甲酯,作者推测在这些条件下产生的任何卡宾物种都将与溶剂反应或二聚形成相应的嗪;2)Stern-Volmer分析表明 2d可以淬灭Ru(dtbbpy)3(PF6)2的发光,而茚没有猝灭,这说明在反应条件下光催化剂与α-碘鎓重氮试剂之间存在相互作用(图6c);3)循环伏安法表明试剂2d(Ered = -0.46 V vs SCE,CH3CN)在强还原性光催化剂激发态*[Ru]II(E(II)∗/(iii)1/2 = -0.81V)下发生单电子转移并生成自由基∙C(N2)COOEt、芳基碘和三氟甲磺酸阴离子(图6d、6e);4)量子产率测量(Φ=11.5)表明该转化是通过有效的链过程进行的。综上,这些结果表明此转化是一个氧化还原过程。另一方面,氘标记底物(6a、6c)在标准条件下进行反应时以高产率和高氘代率提供所需产物(图6f),进而推测反应过程中不发生质子消除过程。其次,向1a和2d的反应中添加自由基清除剂(如:TEMPO和2,6-DTBP)后会明显地抑制反应,并且通过气相色谱-质谱(GC-MS)分析直接观察到中间体6e和 6f,进而表明可能存在自由基中间体(图6g)。此外,1-烯丙基茚6g与2d进行反应时,3a和6h的产率均为24%(图6h);而使用1,1-二甲基茚6i进行反应时,以22%的分离产率获得产物6j(图6i),作者推测这些物种(3a和6j)是通过烯丙基阳离子中间体的重排产生的。
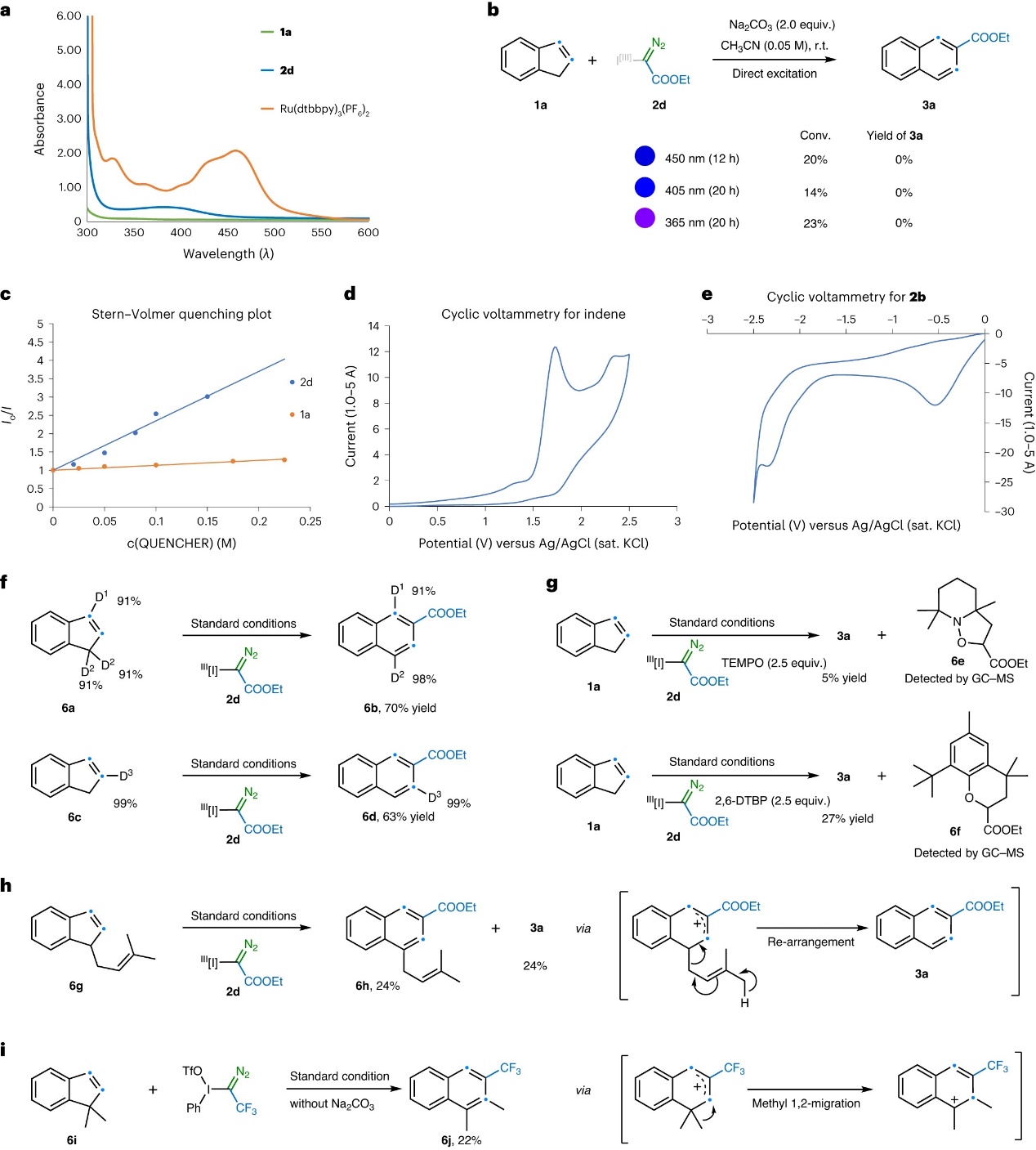
图6. 机理研究。图片来源:Nat. Catal.
最后,作者利用DFT计算对反应机理进行了研究。如图7b所示,三重态 [RuII](T1)与高价碘重氮化合物2f之间发生单电子转移(SET)后均裂I-C键,生成[RuIII]和松散配位的22f。随后,芳基碘和三氟甲磺酸阴离子离去并形成碳中心自由基I•,可以经过渡态I-TS-N2(势垒:27.0 kcal mol-1)释放N2并形成卡拜(图7a)。然而,I•还可以通过更低的能垒(I-TS-II•,8.4 kcal mol-1)区域选择性与1a发生自由基加成并形成稳定的茚自由基II•,这些结果说明卡拜的形成在动力学和热力学上都不利,因此其可能不是该转化的反应中间体。为此,作者考虑了一个自由基环化过程,即中间体II•可以通过II-TS-III•进行分子内环丙烷化,从而生成亚胺自由基III•。反过来,III•可以经过渡态III-TS-IV•以低能垒(0.7 kcal mol-1)释放N2并生成中间体IV•,经IV-TS-VIII•重排生成六元环烯丙基自由基中间体VIII• 。另一方面,作者还通过DFT模拟探索了潜在的可能的自由基链途径,并确定存在两种相互竞争的SET过程,其中第一种途径(path 1,红色)涉及中间体II•的形成,II•与试剂2f进行单电子转移(SET1)并形成阳离子物种II+(热力学上有利)。随后,阳离子促进环闭合形成三元环状中间体III+通过更低的势垒进行(6.4 kcal mol-1 (II-TS- III+)vs 17.6 kcal mol-1(II-TS-III•)),并且III+经III-TS-V+(能垒:11.5 kcal mol-1)释放N2并生成双环中间体V+,再与NaCO3-配位并通过VI-TS-VII进行去质子化得到VII,接着经VII-TS-3a(能垒仅6 kcal mol-1)进行C-C键裂解生成3a。综上,计算结果表明最有利的途径是由II•与2f的SET过程形成自由基链载体I•,然后通过中间体III+进行阳离子环化。另外,第二种途径涉及六元环中间体(VIII•)的形成,其与2f进行单电子转移(SET4)并形成萘阳离子VIII+(path 2,蓝色),但是基于替代阳离子途径排除了该过程。
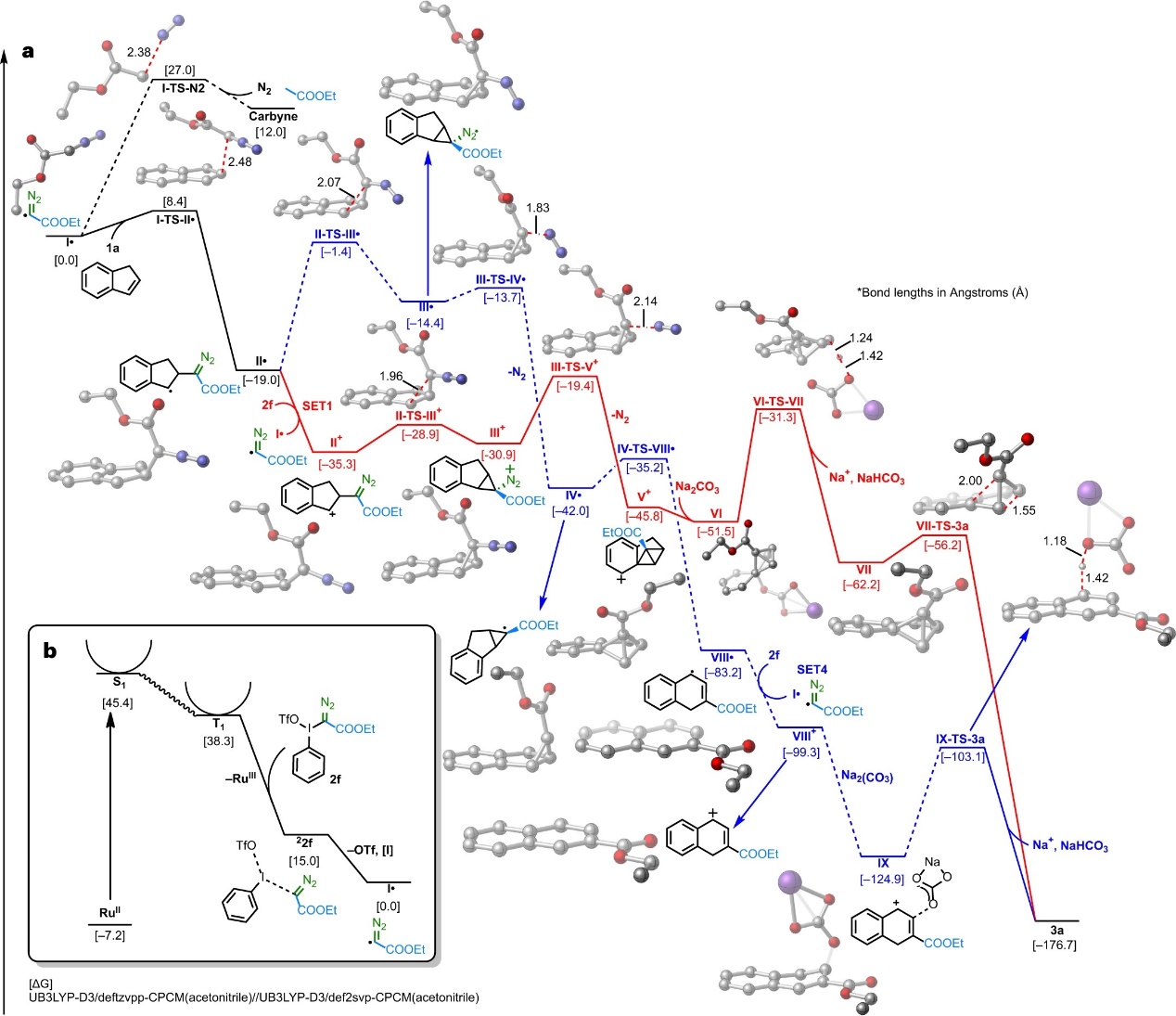
图7. DFT计算。图片来源:Nat. Catal.
总结
本文研究团队利用α-碘鎓重氮化合物作为卡拜自由基前体,通过光氧化还原策略成功地实现了官能化碳原子对茚的插入反应,支持带有包括三氟甲基、酯、磷酸酯、磺酸酯、砜、腈、酰胺、芳基酮和脂肪酮等多种官能团的碳原子,以良好的产率构建了一系列2-位官能团化萘。该方法为芳香环的分子骨架编辑提供了一种新策略。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Ring expansion of indene by photoredox-enabled functionalized carbon-atom insertion
Fu-Peng Wu, Chetan C. Chintawar, Remy Lalisse, Poulami Mukherjee, Subhabrata Dutta, Jasper Tyler, Constantin G. Daniliuc, Osvaldo Gutierrez, Frank Glorius
Nat. Catal., 2024, DOI: 10.1038/s41929-023-01089-x
导师介绍
Frank Glorius
https://www.x-mol.com/university/faculty/46677
Osvaldo Gutierrez
https://www.x-mol.com/university/faculty/331630
(本文由吡哆醛供稿)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!




























 京公网安备 11010802027423号
京公网安备 11010802027423号